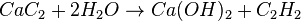Muy buenas coche adictos, todo bien? Ya estamos otra semana mas aquí para ampliar nuestros conocimientos sobre este apasionante mundo, los amovibles y fijos no estructurales. Llevamos muchas entradas explicando el mecanizado, la soldadura, etc. pero no hemos explicado los materiales sobre los que se hace todo en si, así que de ellos va a consistir esta entrada, como habréis leído en el titulo hoy vamos a tratar los materiales metálicos.
Los puntos a tratar seran los siguientes:
- Tipos de enlaces químicos (definición, tipos, características generales)
- El enlace metálico (en profundidad);
- Características de los materiales metálicos;
Metalografía:
Materiales metálicos:
- Clasificación por densidad e importancia industrial;
- El Acero; (descubrimiento, procedencia mineralógica del hierro, importancia histórica, características, propiedades más significativas, estructuras cristalográficas, colores del acero en función de la temperatura)
- El aluminio; (descubrimiento, procedencia mineralógica, características, propiedades más significativas, estructura cristalográfica).
Vamos al lío, empecemos con los tipos de enlaces quimicos. Para hablar de ellos lo primero es saber que son, un enlace químico es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
Una vez que tenemos claro el concepto empecemos con los tipos. Existen muchos tipos de enlaces en la naturaleza pero los tres mas importantes son: enlace iónico, el enlace covalente y el enlace metálico.
- Enlace iónico: un enlace iónico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catión y un anión) o dicho de otra forma, aquel en el que un elemento más electronegativo atrae a los electrones de otro menos electronegativo. El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.
Algunas características de este tipo de enlace son:
- Sus enlaces son muy fuertes (depende fuertemente de la naturaleza de los iones)
- Son sólidos a temperatura ambiente y poseen una estructura cristalina en el sistema cúbico. (Hay compuestos iónicos que son líquidos a temperatura ambiente denominados "líquidos iónicos" o "Sales Derretidas", con un campo de aplicación gigantesco.)
- Altos puntos de fusión (entre 300 °C y 1000 °C) y ebullición (Si el enlace tiene un carácter covalente alto, puede ser que estos valores disminuyan abruptamente)
- Son solubles en agua y otras disoluciones acuosas debido al dipolo eléctrico que presentan las moléculas de agua; capaces de solvatar a los iones, compensando así la energía de red crsitalina. (No todos los compuestos iónicos se pueden solubilizar fácilmente con agua, ya sea por la poca energía de solvatación de los iones o por el carácter covalente del compuesto iónico).
- Una vez en disolución acuosa son excelentes conductores de electricidad, ya que entonces los iones quedan libres.
- En estado sólido no conducen la electricidad, ya que los iones ocupan posiciones muy fijas en la red.

- Enlace covalente: Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel. La diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
Características de moléculas con enlaces covalentes.
- Bajas temperaturas de fusión y ebullición.
- En condiciones normales (25°), estas pueden ser sólidas, líquidas o gaseosas.
- Son blandos en estado sólido.
- Son aislantes de corriente eléctrica y calor.
- Son solubles en agua.
El mas importante para nosotros es el siguiente.

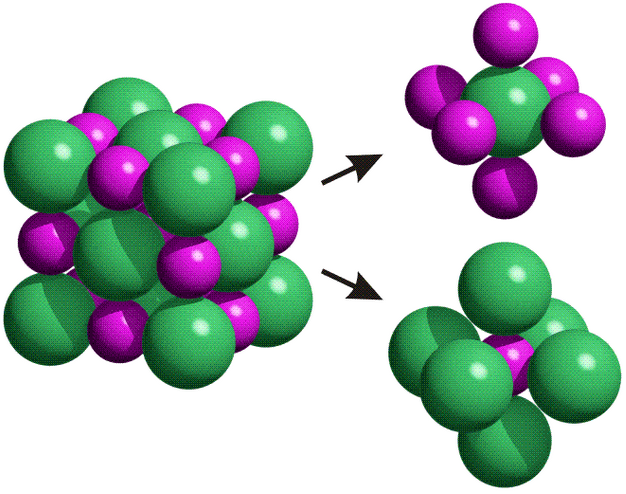
- Enlace metálico: Se llama enlace metálico al tipo de unión que mantiene unidos los átomos de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo).
Propiedades del enlace metálico:
- Características de los metales:
- Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
- Las conductividades térmicas y eléctricas son muy elevadas. (Esto se explica por la enorme movilidad de sus electrones de valencia)
- Presentan brillo metálico.
- Son dúctiles y maleables. (La enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir una rotura)
- Pueden emitir electrones cuando reciben energía en forma de calor.
- Para explicar las propiedades características de los metales se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
- Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3.
Estos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
Los átomos de metal pierden los electrones que le sobran, formándose cationes. Se dice que estos electrones se encuentran deslocalizados (no están en un lugar fijo), Formándose redes cristalinas.
La red cristalina de los metales está formada por átomos (red atómica) que ocupan los nudos de la red de forma muy compacta con otros varios.
Hay tres tipos de redes cristalinas: cúbica centrada en las caras, con coordinación doce; cúbica centrada en el cuerpo.
Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado.
Los cationes permanecen unidos debido a los electrones que rodean al metal.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. La red cristalina metálica puede considerarse formada por una serie de átomos de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto. Los de valencia de los átomos metálicos se liberan y se disponen entre los huecos de los iones positivos a modo de gas electrónico. Se llama Modelo del gas electrónico. Los electrones así distribuidos neutralizan la repulsión entre las cargas positivas. Los átomos se disponen formando redes características.
Ahora que ya hemos explicado los principales tipos de enlaces trataremos las principales características de los materiales metálicos.
Los metales tienen una serie de características que los diferencian de los demás materiales, los no metales. Además de que todos, a excepción del mercurio, son sólidos, la más característica de las propiedades de los metales es su brillo especial, que curiosamente se llama brillo metálico. El brillo es la capacidad de un material para reflejar, absorber o reflectar la luz. Los metales, una vez pulidos, reflejan la mayor parte de la luz que les llega.
Otra característica que cumplen la casi totalidad de los metales es ser buenos conductores eléctricos y mostrar carga eléctrica positiva en los procesos de electrólisis. La estructura electrónica de los átomos metálicos se caracteriza por la existencia de pocos electrones en su capa externa, por lo que se requiere escasa energía para que los pierdan y adopten la estructura estable en forma de cationes. Así muchos son empleados para hacer cables, etc... Además también son buenos conductores del calor.
Los metales son materiales, en general, bastante densos, insolubles en agua y en muchos disolventes, y opacos con un espesor adecuado.
En cuanto a las propiedades metálicas podemos decir que los metales presentan resistencia a la tracción, es decir, que pueden soportar grandes cargas, que se calcula poniendo el material en una cubeta imprimiéndole una fuerza que se aumenta progresivamente y dividiendo la carga máxima de fuerza que se la ha aplicado a la probeta por la sección transversal de la misma.
Los metales son poco duros, así una de las funciones más importantes de las aleaciones es mejorar esta propiedad. La dureza se delimita dejando caer contra una superficie pulida de un metal una bola de acero especial y muy duro (método Brinell) o un diamante piramidal (método Vickers) como ya vimos en una entrada anterior.
Los metales son muy dúctiles, es decir, que se pueden estirar en forma de hilos; y bastante maleables, podemos estirarlos en láminas sin romperlos. Una de las malas propiedades de los metales es su baja resistencia a la fatiga, o la situación en la que se encuentran algunos metales tras ser expuestos a ciclos de carga de una intensidad menor al crítico de rotura del material.
Entre las características en el carácter químico no se puede establecer una relación común a todos los metales ya que, por ejemplo, en el caso de la oxidación, nos encontramos con una diferencia ostensible tanto en tiempo como en la energía liberada. Existen metales inoxidables como el oro y los hay que tardan menos de un día en oxidar su capa exterior a un milímetro de profundidad como el hierro, el cobalto y el bario.
Tras esto va siendo hora de hablar de la metalografia, donde vamos a hablar de la estructura microscópica de los metales, dentro de la cual abarcaremos el grano y el cristal de los metales.
Empecemos diciendo lo que es la metalografia, esta es la disciplina que estudia microscópicamente las características estructurales de un metal o de una aleación.Es posible determinar el tamaño de grano, forma y distribución de varias fases e inclusiones que tienen gran efecto sobre las propiedades mecánicas del metal. La microestructura revelará el tratamiento mecánico y térmico del metal y, bajo un conjunto de condiciones dadas, podrá predecirse su comportamiento esperado.
Empecemos a hablar del grano de los metales.
Todo compuesto cristalino esta compuesto por grano los cuales estan unidos por enlaces quimicos componiendo el material.
El grano se puede clasificar por tamaño.El tamaño de grano tiene un notable efecto en las propiedades mecánicas del metal. Los efectos del crecimiento de grano provocados por el tratamiento térmico son fácilmente predecibles. La temperatura, los elementos aleantes y el tiempo de impregnación térmica afectan el tamaño del grano.
En metales, por lo general, es preferible un tamaño de grano pequeño que uno grande. Los metales de grano pequeño tienen mayor resistencia a la tracción, mayor dureza y se distorsionan menos durante el temple, así como también son menos susceptibles al agrietamiento. El grano fino es mejor para herramientas y dados. Sin embargo, en los aceros el grano grueso incrementa la endurecibilidad, la cual es deseable a menudo para la carburización y también para el acero que se someterá a largos procesos de trabajo en frío.
Todos los metales experimentan crecimiento de grano a altas temperaturas. Sin embargo, existen algunos aceros que pueden alcanzar temperaturas relativamente altas (alrededor de 1800 F o 982 C) con muy poco crecimiento de grano, pero conforme aumenta la temperatura, existe un rápido crecimiento de grano. Estos aceros se conocen como aceros de grano fino. En un mismo acero puede producirse una gama amplia de tamaños de grano.
Existen diversos métodos para determinar el tamaño de grano, como se ven en un microscopio. El método que se explica aquí es el que utiliza con frecuencia los fabricantes. El tamaño de grano se determina por medio de la cuenta de los granos en cada pulgada cuadrada bajo un aumento de 100X. El tamaño de grano especificado es por lo general, el tamaño de grano austenítico. Un acero que se temple apropiadamente debe exhibir un grano fino.
La particularidad fundamental de la constitución de los metales es la distribución perfectamente organizada de sus átomos, característica de todos los cuerpos cristalinos.
La estructura cristalina es la causa a la cual deben los metales una serie de sus propiedades, ausentes en los cuerpos amorfos.
En un metal siempre se puede destacar un conjunto mínimo de átomos (cristal elemental), cuya distribución en el espacio es semejante y se repite reiteradas veces. El enlace de tales conjuntos de átomos forma la red cristalina o cristal, constituida por cristales elementales.
La mayoría de los metales tienen cristales elementales como: cúbico espacial centrado, cúbico centrado en las caras y hexagonal compacto.
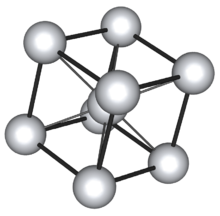
- BCC, red cubica centrada en el cuerpo: Es la estructura en la cual 8 átomos forman los vértices de un cubo y otro el centro del mismo. Se da en todos los metales alcalinos y los metales bario, radio, vanadio, niobio, tantalio, cromo, molibdeno, wolframio y el hierro en el estado alfa (estable a temperaturas ordinarias y hasta 912 °C ).
- FCC, red cubica centrada en las caras o cubica compacta:Este tipo de celda unidad se caracteriza porque los átomos se encuentran localizados en cada uno de los vértices del cubo y uno en el centro de cada una de las caras del cubo.Esta estructura es la del calcio, el estroncio y el bario.

- HCP, red hexagonal compacta:En la estructura hexagonal compacta los átomos ocupan los vértices de un prisma hexagonal regular, los centros de las bases y los centros de los triángulos alternos en que puede descomponerse la sección intermedia del prisma. los metales mas característicos con esta estructura cristalina son Be, Mg, Sc, Ti, Co, Zn, Y, Zr, Ru, Cd, La, Hf, Re, Os y Tl.
Tras esto explicare eñ proceso de cristalización.En los metales y aleaciones líquidas, calentados considerablemente por encima de su punto de fusión, los átomos se agrupan a azar, de modo irregular y son portadores de elevada energía y movimiento. A medida que el líquido se enfría y se acerca al punto de solidificación, la energía de algunos átomos puede haber disminuido y con ello su movilidad dentro de la masa, de tal forma que pueden ocupar, respecto a los otros, una posición más orientada, lo que se asemeja a su disposición en el metal sólido.
Una vez alcanzada la temperatura de solidificación, estos grupos aislados de átomos pueden haber quedado ya orientados y enlazados como el cristal elemental, adquiriendo una estructura rígida de orientación los unos respecto a los otros. Los átomos vecinos pueden, una vez perdida la energía térmica necesaria, irse agregando al cristal elemental formado, formando nuevos cristales elementales unidos y comenzar dentro de la masa líquida a formar redes cristalinas en crecimiento. Estos cristales en crecimiento, cuando alcanzan cierto tamaño se convierten en núcleos de cristalización, y a su alrededor comienza a tejerse la red cristalina, a medida que más y más átomos van perdiendo energía con el enfriamiento.
Como la formación de los núcleos de cristalización puede comenzar indistintamente en cualquier parte de la masa líquida, los cristales pueden comenzar a crecer en múltiples lugares simultáneamente.
En el proceso de cristalización, mientras que el líquido circunde al cristal ya formado y creciente, este va manteniendo una forma relativamente correcta, los átomos vecinos se van enlazando en la posición adecuada y la red cristalina se incrementa manteniendo su geometría. Sin embargo, debido a que la transferencia de calor del material fundido puede ser diferente en diferentes direcciones; por ejemplo, mayor hacia las paredes de molde o recipiente, la red cristalina pueden ir creciendo en unas direcciónes mas que en otras por lo que los cristales van adquiriendo una forma alargada y se constituyen en los llamados ejes de cristalización.

A partir de los primeros ejes, en direcciones perpendiculares tiene lugar el crecimiento de nuevos ejes. A partir de estos nuevos ejes, también en direcciones perpendiculares, crecen otros ejes, que por su parte dan lugar a otros etc. Las ramas formadas van creciendo en dirección de su engrosamiento y multiplicación progresivos, lo que conduce a la interpenetración y formación del cuerpo sólido.
Este tipo de cristalización, que recuerda a un cuerpo ramificado, se conoce como dendrítico, y el cristal formado dendrita.
En el transcurso de su crecimiento dentro de la masa líquida, los cristales empiezan a entrar en contacto, lo que impide la formación de cristales geométricamente correctos, por consiguiente, después de la solidificación completa, la forma exterior de los cristales formados adquiere un carácter casual. Tales cristales se denominan granos y los cuerpos metálicos, compuestos de un gran número de granos, se denominan policristalinos.
Los tamaños de los granos dependen de la velocidad con que se forman y crecen los núcleos.
Tanto la velocidad de formación de los núcleos como la velocidad de su crecimiento depende en gran grado de la velocidad de enfriamiento y de la temperatura de sobrefusión.
A mayor sobrefusión, mayor posibilidad de que se produzcan las condiciones, en diferentes zonas del líquido, para el surgimiento de los núcleos de cristalización.
Un enfriamiento rápido conduce a la formación de muchos núcleos y con ello a un tamaño del grano menor que con lento enfriamiento.
De esta característica se desprende que si se pudiera lograr un enfriamiento lo suficientemente lento, la masa del metal pudiera estar formada por un pequeño grupo de granos casi geométricamente perfectos. Estas condiciones fueron posibles probablemente en el lento enfriamiento de las rocas en la corteza terrestre, y por tal motivo, en ocasiones, pueden encontrarse en la naturaleza grandes cristales de exacta geometría entre las rocas.
Tras esto vamos a por la recta final, ya solo quedan los materiales metálicos, los cuales clasificaremos por densidad e importancia industrial.
Clasificación por densidad: la densidad es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia, normalmente se simboliza mediante la letra ρ, la densidad media es la razón entre la masa de un cuerpo y el volumen que ocupa.
La clasificación de los metales según densidad la adjunto a continuación en la siguiente tabla mostrando desde el menos denso hasta el mas denso.
Dependiendo de las densidades, los metales se usaran para una cosa u otra industrialmente, el aluminio ya que tiene una gran resistencia y una baja densidad es ideal para piezas que necesiten soportar una gran carga y no pesen, en estas aplicaciones también se podría usar el magnesio pero las piezas saldrían mas caras. Ademas el aluminio por su composición molecular es un gran conductos y se utiliza en los cables de alta tensión.
El cobre ya que es un gran conductor se utiliza para el cableado eléctrico.
El wolframio se utiliza para fabricar filamentos de bombilla, ánodos de rayos x y muchas cosas mas.
La plata sobre todo es utilizada para joyas y sistemas eléctricos para soldaduras.
Estos son los principales usos de algunos de los metales conocidos mas usados industrialmente.
Finalmente para acabar esta entrada explicaremos los dos metales que mas usaremos a lo largo del curso, los cuales son el acero y el aluminio.
El acero:
Empecemos por conocer un poco su historia:
Se desconoce la fecha exacta en que se descubrió la técnica para obtener hierro a partir de la fusión de minerales. Sin embargo, los primeros restos arqueológicos de utensilios de hierro datan del 3000 a. C. y fueron descubiertos en Egipto, aunque hay vestigios de adornos anteriores. Algunos de los primeros aceros provienen del este de África, cerca de 1400 a. CDurante la dinastía Han de China se produjo acero al derretir hierro forjado con hierro fundido, en torno al siglo I a. C. También adoptaron los métodos de producción para la creación de acero wootz, un proceso surgido en India y en Sri Lanka desde aproximadamente el año 300 a. C. y exportado a China hacia el siglo V. Este temprano método utilizaba un horno de viento, soplado por los monzones.
El hierro para uso industrial fue descubierto hacia el año 1500 a. C., en Medzamor y el monte Ararat, en Armenia. La tecnología del hierro se mantuvo mucho tiempo en secreto, difundiéndose extensamente hacia el año 1200 a. C.
En 1856, Henry Bessemer, desarrolló un método para producir acero en grandes cantidades, pero dado que solo podía emplearse hierro que contuviese fósforo y azufre en pequeñas proporciones, fue dejado de lado. Al año siguiente, Carl Wilhelm Siemens creó otro, el procedimiento Martin-Siemens, en el que se producía acero a partir de la descarburación de la fundición de hierro dulce y óxido de hierro como producto del calentamiento con aceite, gas de coque, o una mezcla este último con gas de alto horno. Este método también quedó en desuso.
Aunque en 1878 Siemens también fue el primero en emplear electricidad para calentar los hornos de acero, el uso de hornos de arco eléctricos para la producción comercial comenzó en 1902 por Paul Héroult, quien fue uno de los inventores del método moderno para fundir aluminio.
Actualmente, el proceso de fabricación del acero, se completa mediante la llamada metalurgia secundaria. En esta etapa, se otorgan al acero líquido las propiedades químicas, temperatura, contenido de gases, nivel de inclusiones e impurezas deseados. La unidad más común de metalurgia secundaria es el horno cuchara. El acero, aquí producido, está listo para ser posteriormente colado, en forma convencional o en colada continua.
El acero es una aleación compuesta por hierro y carbono, así que aprovechare para explicar un poco el hierro.
El hierro es el metal de transición más abundante en la corteza terrestre, Es el principal metal que compone el núcleo de la Tierra hasta con un 70 %.Se encuentra formando parte de numerosos minerales, entre los que destacan la hematites, la magnetita, la pirita y muchos mas.
Se puede obtener hierro a partir de los óxidos con más o menos impurezas. Muchos de los minerales de hierro son óxidos, y los que no, se pueden oxidar para obtener los correspondientes óxidos.
La reducción de los óxidos para obtener hierro se lleva a cabo en un horno denominado comúnmente alto horno. En él se añaden los minerales de hierro en presencia de coque y carbonato de calcio, CaCO3, que actúa como escorificante.
Tras este pequeño inciso sigamos con el acero, sigamos con las características mas importantes.
- Su densidad media es de 7850 kg/m³.
- El punto de fusión del acero depende del tipo de aleación y los porcentajes de elementos aleantes. El de su componente principal, el hierro es de alrededor de 1510 °C en estado puro (sin alear), sin embargo el acero presenta frecuentemente temperaturas de fusión de alrededor de 1375 °C, y en general la temperatura necesaria para la fusión aumenta a medida que se aumenta el porcentaje de carbono y de otros aleantes. (excepto las aleaciones eutécticas que funden de golpe). Por otra parte el acero rápido funde a 1650 °C.
- Su punto de ebullición es de alrededor de 3000 °C.
- Es un material muy tenaz.
- Relativamente dúctil. Con él se obtienen hilos delgados llamados alambres.
- Es maleable. Se pueden obtener láminas delgadas llamadas hojalata.
- Permite una buena mecanización en máquinas herramientas antes de recibir un tratamiento térmico.
- La dureza de los aceros varía entre la del hierro y la que se puede lograr mediante su aleación u otros procedimientos térmicos o químicos entre los cuales quizá el más conocido sea el templado del acero, aplicable a aceros con alto contenido en carbono, que permite, cuando es superficial, conservar un núcleo tenaz en la pieza que evite fracturas frágiles.
- Se puede soldar con facilidad.
- La corrosión es la mayor desventaja de los aceros ya que el hierro se oxida con suma facilidad incrementando su volumen y provocando grietas superficiales que posibilitan el progreso de la oxidación hasta que se consume la pieza por completo. Tradicionalmente los aceros se han venido protegiendo mediante tratamientos superficiales diversos.
- Posee una alta conductividad eléctrica.
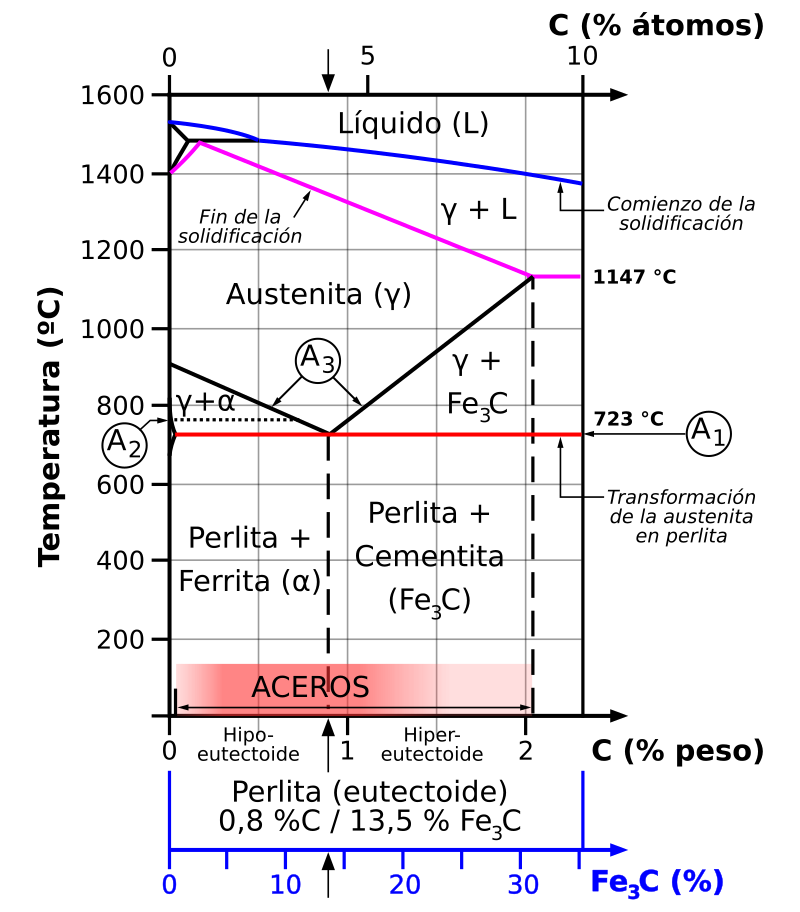
Ademas dependiendo de su temperatura y su proporción entre el hierro y el carbono el acero cambia su composición cristalina la cual se ve claramente en el diagrama antes nombrado de hierro-carbono.
Así se vieran a microscopio los tipos de acero :
El acero a medida que se va calentando va cambiando de color, pasando por una escala de rojos, naranjas y amarillos, como veremos en esta escala:
Ya finalmente hablaremos del aluminio, si lo se esta siendo una entrada un poco larga pero es lo que tocaba hoy.
El aluminio:
El aluminio se utilizaba en la antigüedad clásica en tintorería y medicina bajo la forma de una sal doble, conocida como alumbre y que se sigue usando hoy en día. En el siglo XIX, con el desarrollo de la física y la química, se identificó el elemento En el año 1825, el físico danés Hans Christian Ørsted, descubridor del electromagnetismo, logró aislar por electrólisis unas primeras muestras, bastante impuras. El aislamiento total fue conseguido dos años después por Friedrich Wöhler.
La extracción del aluminio a partir de las rocas que lo contenían se reveló como una tarea ardua. A mediados de siglo, podían producirse pequeñas cantidades, reduciendo con sodio un cloruro mixto de aluminio y sodio, gracias a que el sodio era más electropositivo. Durante el siglo XIX, la producción era tan costosa que el aluminio llegó a considerarse un material exótico, de precio exorbitado, y tan preciado o más que la plata o el oro. Durante la Exposición Universal de 1855 se expusieron unas barras de aluminio junto a las joyas de la corona de Francia. El mismo emperador Napoleón III había pedido una vajilla de aluminio para agasajar a sus invitados. De aluminio se hizo también el vértice del Monumento a Washington, a un precio que rondaba en 1884 el de la plata.
En el año 1889, Karl Bayer patentó un procedimiento para extraer la alúmina u óxido de aluminio a partir de la bauxita, la roca natural. Poco antes, en 1886, el francés Paul Héroult y el norteamericano Charles Martin Hall habían patentado de forma independiente y con poca diferencia de fechas un proceso de extracción, conocido hoy como proceso Hall-Héroult. Con estas nuevas técnicas se incrementó vertiginosamente la producción de aluminio. Si en 1882, la producción anual alcanzaba apenas las 2 toneladas, en 1900 alcanzó las 6700 toneladas, en 1939 las 700 000 toneladas, 2 000 000 en 1943, y en aumento desde entonces, llegando a convertirse en el metal no férreo más producido en la actualidad.
La abundancia conseguida produjo una caída del precio y que perdiese la vitola de metal preciado para convertirse en metal común. Hoy en día las líneas generales del proceso de extracción se mantienen, aunque se recicla de manera general desde 1960, por motivos medioambientales pero también económicos, ya que la recuperación del metal a partir de la chatarra cuesta un 5 % de la energía de extracción a partir de la roca.
Como acabo de decir casi todo el Aluminio se obtiene de un mineral denominado Bauxita que se presenta exógeno en sus yacimientos, arcilla cuyo contenido metálico es de más del 40%. La Bauxita es una mena residual, producida por la meteorización de las rocas ígneas en condiciones geomorfológicas favorables. el aluminio en si no se encuentra en la corteza terrestre.
En el aluminio se pueden distinguir tres tipos de características físicas, mecánicas y químicas.
El aluminio es un elemento muy abundante en la naturaleza, solo aventajado por el oxígeno. Se trata de un metal ligero, con una densidad de 2700 kg/m³, y con un bajo punto de fusión (660 °C). Su color es blanco y refleja bien la radiación electromagnética del espectro visible y el térmico. Es buen conductor eléctrico (entre 35 y 38 m/(Ω mm²)) y térmico (80 a 230 W/(m·K)).
- Características mecánicas:
Es un material blando (escala de Mohs: 2-3-4) y maleable. En estado puro tiene un límite de resistencia en tracción de 160-200 N/mm² (160-200 MPa). Todo ello le hace adecuado para la fabricación de cables eléctricos y láminas delgadas, pero no como elemento estructural. Para mejorar estas propiedades se alea con otros metales, lo que permite realizar sobre él operaciones de fundición y forja, así como la extrusión del material. También de esta forma se utiliza como soldadura.
- Características químicas:
La capa de valencia del aluminio está poblada por tres electrones, por lo que su estado normal de oxidación es III. Esto hace que reaccione con el oxígeno de la atmósfera formando con rapidez una fina capa gris mate de alúmina Al2O3, que recubre el material, aislándolo de ulteriores corrosiones. Esta capa puede disolverse con ácido cítrico. A pesar de ello es tan estable que se usa con frecuencia para extraer otros metales de sus óxidos. Por lo demás, el aluminio se disuelve en ácidos y bases. Reacciona con facilidad con el ácido clorhídrico y el hidróxido sódico.
Las principales propiedades del aluminio son las siguientes:
- El estado del aluminio en su forma natural es sólido.
- El aluminio es un elmento químico de aspecto plateado y pertenece al grupo de los metales del bloque p.
- El número atómico del aluminio es 13.
- El símbolo químico del aluminio es Al.
- El punto de fusión del aluminio es de 933,47 grados Kelvin o de 661,32 grados celsius o grados centígrados.
- El punto de ebullición del aluminio es de 2792 grados Kelvin o de 2519,85 grados celsius o grados centígrados.
Y ahora si que si acabamos hablando de de las propiedades cristalinas de este metal:
Al igual que otros metales pulverizados, el polvo de aluminio arde con flama para dar una nube de polvo de oxido de aluminio:
4 Al(s) + 3 O2 (g) --> 2 Al2O3 (s)
y el aluminio arde de forma muy exotérmica con los halogenos, como el dicloro, por ejemplo:
2 Al(s) + 2 Cl2(g) --> 2 AlCl3 (s)
El aluminio como el berilio, es un metal anfotero que reacciona tanto con acidos como con bases:
2 Al (s) + 6 H+ (ac) --> 2 Al+3 (ac) + 3 H2 (g)
2 Al (s) + 2 OH- (ac) + 6 H2O (l) --> 2 [ Al(OH)4 ]- (ac) + 3 H2 (g)
En solución acuosa el ion aluminio esta presente como hexacualuminio, [ Al(OH2)6]3+ , pero sufre una reacción de hidrólisis para dar una solucion del ion hidroxopentacuoaluminio, [Al(OH2)5(OH)]2+, y el ion hidronio, y después el ion dihidroxotetracuoaluminio:
[ Al(OH2)6]3+ + H2O (l) <--> Al(OH2)5(OH)]2+ (ac) + H3O+ (ac)
Al(OH2)5(OH)]2+ (ac) + H2O (l) <--> Al(OH2)4(OH)2]+ (ac) + H3O+ (ac)
Por tanto las soluciones de sales de aluminio son ácidas, con casi la misma constante de ionizacion del ácido acético. La mezcla que contienen los antitranspirantes y que se conoce comúnmente como hidrato de aluminio es, de hecho, una mezcla de las sales de cloruro de estos dos iones hidroxilados. El ion aluminio de estos compuestos es la especie que constriñe los poros de la superficie de la piel.
Cuando se agrega el ion hidroxido al ion aluminio primero se obtiene un precipitado gelatinoso de hidroxido de aluminio, pero este producto reacciona posteriormente en un exceso de ion hidroxido para dar el ion aluminato:
[ Al(OH2)6]3+ (ac) ----> Al(OH)3 (s) ----> [ Al(OH)4 ]- (ac)
OH OH
En consecuencia, el aluminio el soluble a pH bajo y alto pero insoluble en condiciones neutras. El hidroxido de aluminio se utiliza en varias formulaciones de antiacidos. Al igual que otros antiacidos, este compuesto es una base insolubleque neutraliza el exceso de acido estomacal:
Al(OH)3 (s) + 3 H+ (ac) --> Al3+ (ac) + 3 H2O (l)
El aluminio es muy reactivo, debido a su elevado potencial de reducción estándar. Entonces, ¿ Porque usar tan cotidianamente este material tan reactivo, en lugar de quedar confinado en un laboratorio?
La respuesta a esta pregunta esta en su reacción con el oxigeno, cualquier superficie metálica reacciona rápidamente con el oxigeno para formar,oxido de aluminio Al2O3 . Una capa impermeable de oxido de aluminio de unos 10-4 10-6 mm de grosor, protege las capas de átomos de aluminio subyacentes. Esto sucede porque el ion oxigeno tiene un radio ionico similar al átomo de aluminio metálico. Esto hace que no varié su estructura ya que los pequeños iones aluminio encajan en los huecos intersticiales del oxido.
Los productos de aluminio se "anodizan" con el fin de aumentar su resistencia a la corrosión.
Bueno chicos y esta entrada ya se acabo, espero que os ayude y hayáis aprendido algo, la próxima entrada esta al caer y esta vez sera de los materiales sintéticos. Bueno coche adictos un fuerte abrazo y asta la próxima.
.